Ein Schritt in Richtung künstliche Lebermodelle:
Die anspruchsvollen Tools der GeSiM Biodrucker ermöglichen Tissue Engineering auf hohem Niveau. An dieser Stelle präsentieren wir die jüngste Veröffentlichung des Zentrums für Translationale Weichgewebeforschung an der Medizinischen Fakultät der TU Dresden.
Die Leber ist ein ziemlich komplexes Organ, bestehend aus verschiedenen Zelltypen mit spezifischen Funktionen, angeordnet in speziellen Formen wie kleine „Läppchen“. Das Bioengineering von 3D Leberkonstrukten ist somit herausfordernd, bietet aber großes Potential für die Wirkstoffsuche/ toxische Tests wie auch für Krankheitsmodelle. Die Entwicklung eines Co-Kultur Systems mit dem Core/Shell Extruder am GeSiM BS3.1 Biodrucker war ein Teil dieser Studie. Das Core/Shell Tool ermöglicht große Kontaktflächen zwischen zwei unterschiedlichen Phasen.
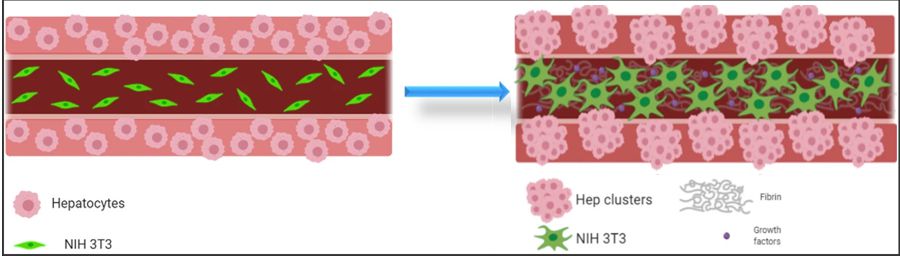
Grafische Darstellung des Hepatozyten-Fibroplasten Co-Kultur Konzepts, die Hepatozyten in der Shell-spur werden mit NIH 3T3 Fibroplasten in der Core-Spur zusammen gedruckt in koaxialer Anordnung, jeweils mit ihrer entsprechenden Bioink. Ein Einfluss der Zusammensetzung der Core-Spur (mit oder ohne Fibroplasten und Matrix-Komponenten) auf den Phenotyp der Hepatozyten wird vermutet, da diese innerhalb des Shell-Volumens in Clustern wachsen können und Fibroblasten Netzwerke während der Kultivierungsperiode ausbilden. Die Schemas wurden mit der Software Biorender.com kreiert.
Hepatozyten wurden in Alginat-Methylzellulose (Alg/MC)/ Matrigel Gemische eingekapselt für die Shell-Spur, während Fibroplasten für die Core Spur in Alg/MC eingeschlossen wurden. Die Fibroblasten fungierten als unterstützende Zellen, da sie die Expression bestimmter Biomarker der Hepatozyten stimulieren, z.B. Albumin. Mehr Informationen zu den von den Autoren des Papiers entwickelten Alginat-Methylzellulose Bioinks sind auf der Applikationsseite der GeSiM Biodrucker verfügbar.
Es konnte gezeigt werden, dass die Hepatozyten sich bei allen Bedingungen vermehren und multizellulare Cluster bilden. Die Clustergröße jedoch war speziell erhöht bei den Co-Kultur Experimenten mit Fibroblasten, simultan gedruckt in Core/Shell Anordnung.
Diese Machbarkeitsstudie berücksichtigte verschiedene Bioink-Zusammensetzungen (Alg/MC mit und ohne bioaktive Komponenten), ebenso wie Co-Kulturen vs. Monokulturen.
Für mehr Informationen laden Sie bitte den vollständigen Artikel herunter (unten).
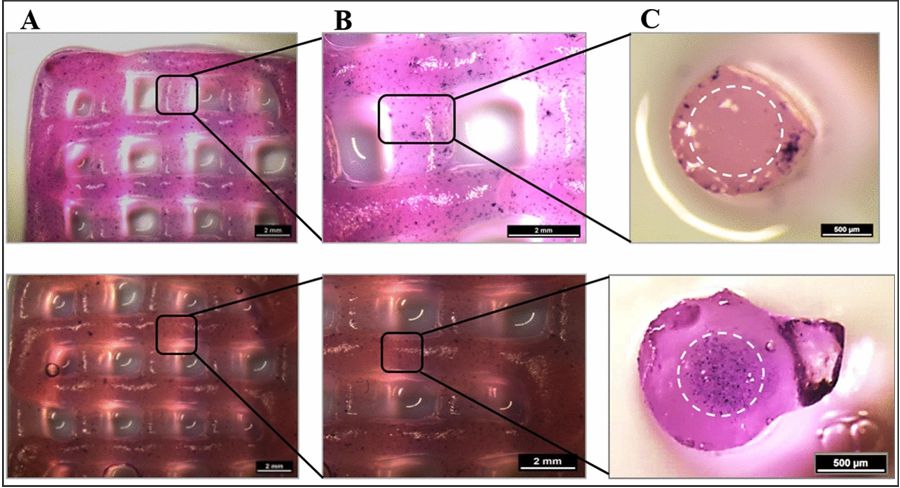
Stoffwechselaktivität nach 7 Tagen Kultivierung (MTT markiert, violett) der HepG2- und NIH 3T3 Zellen, eingebetted in einem Core/Shell gedruckten Scaffold; das Core/Shell Interface ist mittels weißer Linien in C. dargestellt.
Die oberen Kacheln zeigen HepG2 Zellen, eingeschlossen in der Shell-Spur in Alg/MC und Matrigel, die Core-Spur ist zellfrei. Die unteren Kacheln zeigen NIH 3T3 Zellen, eingeschlossen in der Core-Spur in Alg/MC, während die Shell-Spur zellfrei ist. (A, B) Maßstabsbalken 2mm. (C) Maßstabsbalken 500 µm.
[1] Rania Taymour, David Kilian, Tilman Ahlfeld, Michael Gelinsky & Anja Lode: 3D bioprinting of hepatocytes: core–shell structured co‑cultures with fibroblasts for enhanced functionality, scientific reports, veröffentlicht 4th March 2021


![Zellfreier Core/Shell Strang Ein stereomikroskopisches Bild eines zellfreien Core/Shell Strang, mäanderförmig abgelegt, mit klarer Separation von Core-Spur (Alg/MC) und Shell-Spur (Alg/MC + Matrigel), Maßstabsbalken 2 mm. [1]](https://gesim.de/wp-content/uploads/2021/03/CoreShell_strand_blackwhite.jpg)
![Core/Shell Strang mit markierter Core-Spur Stereomikroskopisches Bild eines zellfreien, gedruckten Scaffolds mit blau eingefärbter Core-Spur zur Visualisierung des kontinuierlichen Verlaufs durch den koaxialen Strang; das Insert zeigt einen herausgeschnittenen Aussschnitt des Strangsegments. [1]](https://gesim.de/wp-content/uploads/2021/03/CoreShell_strand_stained.jpg)

